nex 18 FÖR
BEHANDLING AV mDS (MYELODYSPLASTIC SYNDROME)

Vad är
VAD ÄR MDS?
Myelodysplastiskt syndrom (MDS) är en grupp aggressiva och långvariga blodcancersjukdomar. De orsakar ett brett spektrum av ytterst påfrestande symtom, från illamående, yrsel och andnöd till blödningar och återkommande infektioner.
Fyrtio procent av alla MDS-patienter anses vara utsatta för hög eller mycket hög risk, med en överlevnadsprognos på cirka 2 år (1). MDS kallas ofta ”pre-leukemi” eftersom en tredjedel av patienterna så småningom utvecklar akut myeloisk leukemi (AML).

Medianålder vid diagnos är 76 år
Majoriteten av patienterna är över 65 år
Endast 6% av patienterna är under 50 år (2)
FÖREKOMST
MDS förekommer främst hos äldre. Sjukdomen ökar i takt med att andelen äldre människor ökar, samtidigt som behandlingsresultatet under de senaste decennierna sakta har förbättrats (3). 2020 insjuknade 250 000 patienter globalt, en siffra som spås öka till 310 000 patienter år 2028 (4).
Antal nyinsjuknande
i MDS globalt
Afrika
Europa
Nordamerika
Asien
Latinamerika och Västindien
Oceanien
AZACITIDIN: GRUNDBEHANDLING FÖR MDS SOM ÄR ANSTRÄNGANDE BÅDE FÖR PATIENTEN OCH VÅRDEN
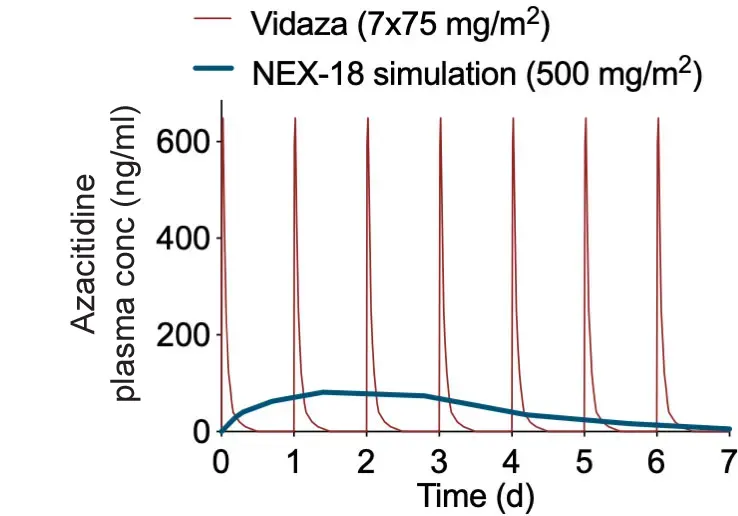
Vid MDS är första linjens behandling azacitidin (produktnamn: Vidaza®) som administreras med subkutana injektioner. Terapin är alltjämt obehaglig, opraktisk och krävande, i synnerhet för äldre patienter.
Varje behandlingscykel har 28 dagar och under de första 7 dagarna av denna period måste patienterna dagligen uppsöka närmaste infusionsklinik. Sammanlagt tillbringar de runt 30 timmar på kliniken under varje cykel. Injektionerna behöver övervakas noggrant och varje gång tar återhämtningen cirka två timmar. Före och efter varje behandlingscykel med azacitidin ska en komplett blodstatuskontroll göras för att fastställa behandlingssvar och toxicitet. Illamående och kräkningar är vanliga biverkningar och starka antiemetika administreras rutinmässigt före injektionerna.
Denna behandlingsregim är inte bara besvärlig för patienterna utan också dyr för sjukvården jämfört med en enda injektion per månad av NEX-18. Här finns således ett reellt medicinskt behov hos patienter, anhöriga och vårdgivare som inte tillgodoses och som NEX-18 skulle kunna fylla.
(1) Cancer.org
(2) https://www.healthline.com/health/mds-prognosis
(3) US National Library of Medicine 2017, Myelodysplastic Syndromes and Acute Myeloid Leukemia in the Elderly
(4) Datamonitor MDS Spotlight Mars 2022
injektioner
NEX-18 MINSKAR ANTALET INJEKTIONER FRÅN 1 PER DAG sju dagar i sträck TILL 1 per månad
För en behandlingscykel med NEX-18 så ersätts de 7 injektionerna med EN injektion med NEX-18 dag 1. Denna förenkling av behandlingen ger en stor fördel både för patienter och vårdgivare, genom mindre resor samt mer tid till annat för patienten och mindre behov av dyrbara resurser hos vårdgivarna. Detta leder till ökad livskvalitet för patienten och lägre kostnader för vården/betalare.
MINSKA DEN INITIALA FRISÄTTNING
Kontrollerad frisättning
FÖR smartare VÅRD
Patienterna uppger (5) att azacitidin i regel ger de svåraste biverkningarna i början av varje behandlingscykel samt under de första två behandlingscykler som patienten genomgår.
Biverkningar av AZACITIDINE
Illamående, yrsel, ångest, anemi, diarré, muskel- och ledvärk, neutropeni, infektioner, sepsis, sömnrubbningar, njursvikt.
Om den initiala ”koncentrationstoppen” vid frisättningen reduceras med hjälp av NEX-18 kan det eventuellt minska de akuta biverkningarna från behandlingen. NEX-18 är azacitidin-partiklar som är helt inneslutna av en PharmaShell-ytbeläggning, som gör att en låg, kontinuerlig dos av den aktiva substansen frisätts under behandlingscykelns gång.
Två olika studier har visat att PharmaShell minskade den initiala frisättningen av testläkemedlet indometacin till 1/28 jämfört med den ursprungliga formuleringen, och att läkemedlet frisattes i en låg och jämn takt under loppet av flera veckor (studierna publicerades i de referentgranskade vetenskapliga tidskrifterna European Journal of Pharmaceutics and Biopharmaceutics respektive International Journal of Pharmaceutics).
(5) https://mdspatientsupport.org.uk/latest-news/mds-patient-stories-2/
(6) Joel Hellrup, Mårten Rooth, Emma Mårtensson, Kalle Sigfridsson, Anders Johansson, 2019. Nanoshells prepared by atomic layer deposition – Long acting depots of Indomethacin. European Journal of Pharmaceutics and Biopharmaceutics 140, 60–66. doi:https://doi.org/10.1016/j.ejpb.2019.04.019.